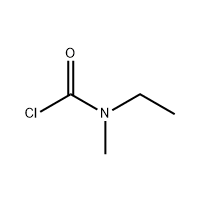
Acido 3′-ammino-2′-idrossi-[1,1'-bifenile]-3-carbossilico
Acido 3′-ammino-2′-idrossi-[1,1'-bifenile]-3-carbossilico
L'acido 3'-ammino-2'-idrossi-[1,1'-bifeny]-3-carbossilico è usato come intermedio di Eltrombopag.
Eltrombopag, sviluppato da GlaxoSmithKline (GSK) nel Regno Unito e successivamente sviluppato congiuntamente con Novartis in Svizzera, è il primo e unico agonista del recettore TPO non peptidico di piccole molecole approvato al mondo.Eltrombopag è stato approvato dalla FDA statunitense nel 2008 per il trattamento della porpora trombocitopenica idiopatica (ITP) e nel 2014 per il trattamento dell'anemia aplastica grave (AA).È anche il primo farmaco approvato dalla FDA statunitense per il trattamento dell'AA negli ultimi 30 anni.
Nel dicembre 2012, la FDA degli Stati Uniti ha approvato Eltrombopag per il trattamento della trombocitopenia nei pazienti con epatite C cronica (CHC), in modo che i pazienti con epatite C con prognosi infausta a causa della bassa conta piastrinica possano iniziare e mantenere la terapia standard a base di interferone per le malattie del fegato.Il 3 febbraio 2014, GlaxoSmithKline ha annunciato che la FDA ha concesso la qualifica di farmaco innovativo per il trattamento di Eltrombopag per il trattamento dell'emopenia in pazienti con grave anemia aplastica da libro chimico (SAA) che non hanno risposto completamente all'immunoterapia.Il 24 agosto 2015, la FDA degli Stati Uniti ha approvato Eltrombopag per il trattamento della trombocitopenia in adulti e bambini di età pari o superiore a 1 anno con trombocitopenia immunitaria cronica (ITP) che hanno una risposta insufficiente a corticosteroidi, immunoglobuline o splenectomia.Il 4 gennaio 2018, Eltrombopag è stato approvato per essere elencato in Cina per il trattamento della trombocitopenia immunitaria primaria (ITP).


![Acido 3′-ammino-2′-idrossi-[1,1'-bifenile]-3-carbossilico Immagine in primo piano](http://cdn.globalso.com/jindunchem-med/image351.png)
![Acido 3′-ammino-2′-idrossi-[1,1'-bifenile]-3-carbossilico](http://cdn.globalso.com/jindunchem-med/image351-300x300.png)
![6-tetra-O-acteil-1-C-[4-cloro-3-[[4-[[(3S)-tetraidrofu-ran-3-il]ossi]fenile]](http://cdn.globalso.com/jindunchem-med/0ecf55f0-300x300.jpg)